Dossier n°23, décembre 2007
À la lueur d'une protéine
par Séverine Altairac
![[ À la lueur d'une protéine ]](/prolune/images/prolune_cover023.jpg)
Les soirées de décembre sont les plus lumineuses de l'année. Les décorations de Noël éclairent les places et les avenues, les vitrines étincellent de doré et d'argent et les arbres scintillent de guirlandes. Aux portes de la ville, la Nature, elle, n'a point besoin d'artifices pour briller. Selon les saisons et les espèces animales ou végétales, elle éblouit par ses couleurs douces ou flamboyantes. Plus fascinant encore, elle sait produire de la lumière. A l'origine de ce qu'on appelle la luminescence des êtres vivants se trouvent des protéines. L'une d'entre elles est devenue un outil expérimental incontournable des chercheurs : la GFP pour "Green Fluorescent Protein" - la protéine fluorescente verte. [PDF] [english]
Dans le clair-obscur marin
Maints êtres vivants émettent de la lumière. La luciole et son abdomen vert brillant sont bien connus de nos jardins. Plus largement divers insectes, vers de terre, bactéries et champignons se partagent cette étonnante faculté. Cependant, c'est dans les ténèbres des fonds marins qu'il faut s'enfoncer pour observer l'étendue de la diversité des espèces luminescentes. Plus de 700 organismes ont été recensés et beaucoup encore demeurent inconnus car ils vivent à des profondeurs à ce jour non explorées. Parmi eux le phytoplancton, des crevettes, des calmars, des méduses, des coraux et des poissons possèdent des organes lumineux ou co-habitent avec des bactéries luminescentes. Alors que les espèces terrestres émettent des couleurs variées - bleue, verte, jaune ou rouge -, les espèces marines s'illuminent généralement de bleu ou de vert, ondes lumineuses qui se propagent le mieux dans l'eau.
La capacité qu'ont les êtres vivants à produire et à diffuser de la lumière est nommée bioluminescence. Et pourquoi donc briller ? Dans l'ombre des océans ou de la nuit, émettre de la lumière représente un atout et les animaux luminescents se révèlent très imaginatifs quant à son utilisation. Un des rôles de la bioluminescence, somme toute évident bien que peu fréquent, est l'éclairage. Un exemple éloquent est le cas de certaines lucioles nocturnes qui illuminent la feuille sur laquelle elles vont atterrir. Toujours chez les lucioles, l'émission lumineuse se transforme en un langage de communication lors des parades sexuelles, au cours desquelles mâles et femelles s'adonnent à de véritables conversations. C'est toutefois dans l'attraction des proies et dans la protection contre les prédateurs que la bioluminescence reste le plus employé. Les méduses lancent des "éclairs" afin de repousser un poisson mal intentionné. Les poissons lanternes mâles, armés d'une sorte de petite ampoule se balançant au-dessus de leur tête, attirent les prédateurs pour les éloigner des femelles laissées dans l'obscurité. D'autres poissons dont la silhouette sombre se découpe sous la surface de l'eau se dissimulent en éclairant leur face ventrale, dans le but de se fondre dans la lumière du jour.
Un coup du hasard
La bioluminescence est évoquée pour la première fois par Aristote (384-322 av. JC) qui l'observe sur des poissons morts recouverts de bactéries luminescentes. Il la qualifie alors de lumière froide après avoir constaté qu'elle ne dégageait pas de chaleur. Au début de notre ère, Pline l'Ancien poursuit le travail d'observation initié par Aristote et s'attache à décrire plusieurs organismes luminescents. Ce n'est qu'à la fin du XVIIème siècle - après plus de mille ans ! - que certains savants s'intéressent à la compréhension de ce phénomène et la preuve est faite que l'oxygène est indispensable à la production lumineuse un siècle plus tard. Enfin, Raphaël Dubois découvre en 1887 qu'une réaction chimique est à l'origine de la bioluminescence : l'oxydation d'un composé baptisée luciférine par un catalyseur nommé luciférase s'accompagne d'une émission lumineuse.

Fig.1 Dessin de la méduse Aequorea victoria. La GFP se localise à la base circulaire de son ombrelle, d'où s'élancent les tentacules.
La caractérisation des deux facteurs se révèle difficile et fait un bond en avant au début des années 1960. A cette époque, le jeune japonais Osamu Shimomura entreprend d'identifier la luciférase et la luciférine chez l'Aequorea victoria, une méduse luminescente qui vit dans le Nord-Ouest du Pacifique, le long de la côte (Fig.1). D'un diamètre de cinq à dix centimètres, l'Aequorea victoria porte aussi le nom de "crystal jelly" - gelée de cristal - du fait de sa transparence. La petite méduse émet des rayons verts à la base de son ombrelle, probablement suite à une stimulation mécanique telle qu'un contact ou des mouvements de l'eau. Ainsi, la méduse ne laisse apparaître d'elle qu'un fin cercle lumineux, visible la nuit avec surtout un peu de chance.
De ces méduses O. Shimomura extrait une protéine - qui renferme à la fois la luciférase et la luciférine - à laquelle il donne le nom d'aequorine. Mais étrangement, l'aequorine isolée n'émet pas de lumière verte mais une lumière bleue. Pourquoi ? Parce que les extraits cellulaires renferment une autre protéine qui est, elle, responsable de l'émission verte. C'est la green fluorescent protein, la GFP.
Deux protéines lumineuses, l'une bleue et l'autre verte. Pourtant l'Aequorea victoria ne s'irradie que de vert. Pourquoi ? O. Shimomura le comprendra bien plus tard. Il démontrera alors que l'activité de la GFP est d'absorber la lumière bleue émise par l'aequorine et de la transformer en lumière verte. Quel est l'avantage pour la méduse ? Une des explications avancées est que la longueur d'onde "verte" constituerait un signal répulsif plus puissant vis à vis des prédateurs.
Du feuillet au tonneau
Cependant le mystère flottant autour de la GFP à l'époque de sa découverte éveille peu d'intérêt et la protéine sombre dans l'oubli jusqu'en 1992, date à laquelle son gène fut décrypté. S'ensuit la résolution de sa structure en 1996 qui met au jour une nouvelle structure fascinante en forme de tonneau. Comment une protéine acquiert-elle pareille structure ?
Toute protéine se compose d'une succession d'acides aminés - nommée séquence - comme un collier se compose d'un enchaînement de perles. Cette chaîne d'acides aminés se replie progressivement sur elle-même pour donner à la protéine sa forme spécifique. Comment ?
Dans un premier temps, certains acides aminés situés proches dans la séquence s'attirent mutuellement. Un peu à la manière de deux aimants, ils se rapprochent et établissent entre eux des contacts ou plus précisément des liaisons faibles - les liaisons hydrogène. Ces liens locaux entre acides aminés génèrent essentiellement deux motifs structuraux : l'hélice α et le feuillet β. Dans l'hélice α, l'attraction des acides aminés enroule la chaîne protéique comme dans un ressort. Dans le feuillet β, plusieurs petites portions de la séquence - appelés brins - s'assemblent les unes à côté des autres et donnent à ce motif des allures d'accordéon (Fig.2).
Finalement, les deux types de structures locales s'assemblent dans l'espace pour modeler la forme globale de la protéine, autrement dit sa structure tridimensionnelle.
Dans le cas de la GFP, la forme "tonneau" repose sur l'existence d'un feuillet β à onze brins. Tel une feuille de papier que l'on courbe pour obtenir un tube, le feuillet de la GFP se referme sur lui-même dans un baril presque parfait, obturé à ses extrémités par des boucles d'acides aminés (Fig.2).
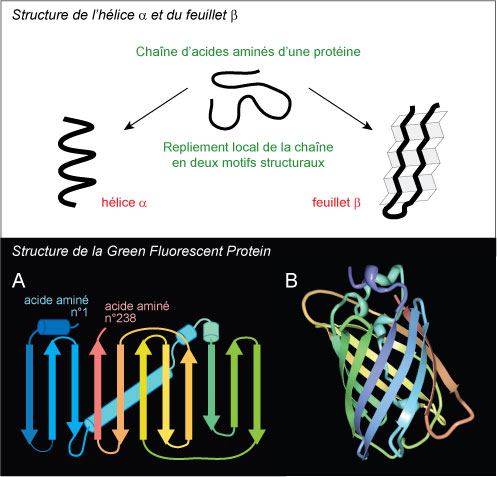
Fig.2 Structures. En haut, Représentation schématique de l'hélice α et du feuillet β. En bas, A, Mise à plat de l'enchaînement des motifs locaux dans la GFP : les hélices α sont représentées par des cylindres et le feuillet β par l'ensemble des flèches. B, Structure tridimensionnelle de la GFP. Elle est le résultat du repliement dans l'espace des hélices α et du feuillet β.
Un cœur fluorescent
La structure "tonneau" joue-t-elle un rôle dans la fluorescence de la GFP ? Oui. La forme compacte de la protéine tient à l'abri, de tout dommage chimique, une hélice α qui renferme la source lumineuse. L'élément responsable de l'activité fluorescente est ce que l'on appelle un chromophore. Il est constitué d'une séquence de trois acides aminés, sérine - tyrosine - glycine. Pour devenir fonctionnel, le chromophore doit subir une modification spécifique catalysée par la GFP elle-même et avec l'unique aide de l'oxygène.
Une fois le chromophore fonctionnel, la protéine est capable de diffuser de la lumière mais elle doit avant tout en absorber. C'est le principe de la fluorescence. Précisons que la lumière du soleil se décompose en six couleurs visibles pour l'œil humain - violet, bleu, vert, jaune, orange et rouge - et en deux couleurs imperceptibles - l'ultraviolet et l'infrarouge. La lumière absorbée par la GFP est l'ultraviolet et le bleu. L'énergie ainsi capturée sous forme lumineuse déstabilise la protéine qui ne demande qu'à revenir à son état initial. Pour y parvenir, elle libère un grain de lumière (ou photon) de couleur verte.
Une carrière éblouissante
La GFP a cela d'extraordinaire qu'elle acquiert sa propriété fluorescente d'elle-même. Aucune enzyme ne lui est nécessaire, juste un peu d'oxygène. C'est ce qui émoustilla tant les biologistes. Il suffit d'introduire le gène de la GFP dans une cellule pour observer ensuite la fluorescence verte de la protéine sous un éclairage bleu. Non seulement la protéine n'est pas toxique pour la cellule mais, de surcroît, l'observation de sa fluorescence ne compromet pas sa survie. C'est ce qui a fait de la GFP un outil expérimental de choix dans l'étude des processus biologiques dans des cellules ou des organismes vivants.

Fig.3 Localisation de la protéine "engrailed" chez la mouche Drosophila melanogaster. Le gène de la GFP a été modifié de telle sorte que la GFP s'exprime au même moment et au même endroit que la protéine engrailed. La fluorescence verte indique donc, par voie de conséquence, que la protéine engrailed se situe normalement dans la partie postérieure des ailes et dans certains segments ventraux.
Des cellules fluorescentes, à quoi cela sert-il ? A les rendre visibles et à découvrir leur devenir. Par exemple, insérer la GFP dans des cellules cancéreuses permet ensuite d'étudier la progression des tumeurs chez un animal de laboratoire. De même, "étiqueter" des neurones avec la GFP chez de jeunes souriceaux révèlera leur migration et leur évolution dans le cerveau, indices du développement cérébral.
La GFP est également employée afin de visualiser quelque chose de plus petit encore qu'une cellule : les protéines. Différentes techniques ont été mises au point pour l'étude de leur fonction. Une première de ces méthodes vise à déceler où et quand dans un organisme une protéine d'intérêt est fabriquée - dans le cerveau, les membres inférieurs ou le système digestif par exemple (Fig.3). Puis, pour répondre à des questions plus précises sur le rôle de la protéine dans la cellule, une deuxième méthode peut être mise en œuvre, celle de la "protéine fusion". En pratique, le gène de la GFP est "accolé" au gène de la protéine d'intérêt comme une caravane à une voiture. Les cellules fabriquent alors une "protéine fusion" dans laquelle les deux protéines sont liées, sans que cela altère la protéine d'intérêt. Grâce à la fluorescence de la GFP, la protéine devient observable. C'est comme si on y avait accroché une ampoule. Le recours à ce procédé donne accès à une foule d'informations sur la protéine. Lesquelles ? Observer dans la cellule vivante à quel moment et dans quel compartiment la protéine est synthétisée, si elle se déplace, si elle est sécrétée hors de la cellule ou si elle interagit avec d'autres protéines (Fig.4).
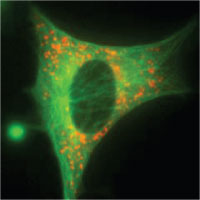
Fig.4 Visualisation de la tubuline fusionnée à la GFP, dans une cellule de souris. La tubuline est une protéine participant à l'architecture cellulaire. La fluorescence verte montre des fibres de tubuline qui traversent la cellule de part en part. La zone sombre situe le noyau renfermant l'ADN.
Par ailleurs, la technique de la "protéine fusion" peut se révéler utile pour s'assurer qu'une protéine particulière a été correctement introduite dans un organisme. La fluorescence de la GFP, qui apparaît lorsque l'organisme est éclairé avec de la lumière bleue, certifie ainsi la présence de la protéine en question. Cette technique a été testée, entre autres, chez le tabac pour vérifier l'insertion d'un gène qui rendrait la plante résistante à un herbicide.
La fluorescence de la GFP s'avère en revanche très sensible aux conditions expérimentales et notamment aux variations de l'acidité dans la cellule. Ce qui aurait pu être le talon d'Achille de la GFP est finalement devenu une nouvelle manière d'utiliser la protéine. Les variations d'intensité de la fluorescence de la GFP normale ou de GFP modifiées permettent d'observer dans la cellule les fluctuations de l'infiniment petit comme l'évolution de l'acidité, justement, ou les changements de concentrations du calcium par exemple.
L'outil révolutionnaire de la GFP a attisé l'imaginaire des biologistes. Est-il envisageable de visualiser plusieurs phénomènes simultanément ? Peut-on dans ce but fabriquer des GFP de couleurs différentes? Oui. L'inspiration fut trouvée chez les coraux et les anémones de mer qui expriment des protéines fluorescentes "FP" semblables à la GFP mais qui brillent en bleu, jaune et orange-rouge. Et aujourd'hui grâce aux GFP modifiées, les chercheurs ont, entre leurs mains, des outils prodigieux qui reproduisent toutes les couleurs de l'arc-en-ciel.
Une multitude d'autres GFP mutées existent. Certaines résistent mieux à la chaleur tandis que d'autres changent de couleur au cours du temps. Parmi elles, une GFP modifiée a récemment dévoilé sa surprenante propriété : elle clignote et ce de moins en moins vite avec l'augmentation de la température. Le thermomètre moléculaire est né et avec lui un outil de contrôle thermique pour les expériences les plus délicates.
La GFP n'a pas seulement fait rêver les biologistes. La beauté de sa structure a inspiré le sculpteur suisse Julian Voss-Andreae qui a créé une oeuvre imposante en acier. Les animaux GFP ont interpellé l'Américain Eduardo Kac qui se proclame "artiste transgénique". Née en 2000, Alba est la première lapine possédant la GFP. Exposé à la lumière bleue, elle s'illumine de vert. En créant Alba, Eduardo Kac a souhaité étayer un débat sur les rapports entre science et art, et s'interroger sur l'éthique des biotechnologies. D'autres en revanche ont moins d'états d'âmes en imaginant des plantes ornementales fluorescentes ou même des sapins de Noël aux branches clignotantes. Outil expérimental ou gadget, la GFP n'a pas fini de nous éclairer !!


